LARUTAN ELEKTROLIT DAN NONELEKTROLIT
LARUTAN ELEKTROLIT DAN NONELEKTROLIT
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena mengalami reaksi ionisasi, yaitu reaksi pembentukan ion-ion. Semua larutan anorganik, baik asam, basa, maupun garam memiliki sifat menghantarkan arus listrik.
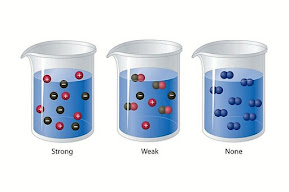
larutan elektrolit terbagi menjadi dua yaitu Larutan elektrolit kuat dan elektrolit lemah. Larutan Elektrolit Kuat adalah larutan elektrolit yang terurai sempurna menjadi ion atau mengalami ionisasi sepenuhnya dalam larutan air atau dalam keadaan lebur.
Ciri-ciri larutan elektrolit kuat adalah larutan yang sepenuhnya terionisasi untuk membentuk ion bebas ketika dilarutkan, dan tidak ada molekul netral yang terbentuk dalam larutan.
Semakin banyak tersedianya ion bebas dalam suatu elektrolit, semakin besar kapasitasnya untuk membawa atau menghantarkan arus.
Berikut adalah contoh larutan elektrolit kuat dari asam kuat:
Asam klorida (HCl)Asam bromida (HBr) Asam hidrogen iodida (HI) Asam nitrat (HNO3) Asam klorat HClO3) Asam perklorat(HClO4) Asam sulfat (H2SO4)
Elektrolit kuat dari basa kuat Berikut adalah contoh larutan elektrolit kuat dari basa kuat: Natrium hidroksida (NaOH) Litium hidroksida (LiOH) Kalium hidroksida (KOH) Kalsium hidroksida (Ca(OH2)) Barium hidroksida (Ba(OH2)) Rubidium hidroksida (RbOH) Sesium hidroksida (CsOH) Stronsium hidroksida (CsOH)
Elektrolit kuat dari garam Elektrolit kuat juga berasal dari senyawa ionik yang tidak bermuatan atau biasa disebut dengan garam. Berikut adalah contoh garam elektrolit kuat: Natrium klorida (NaCL) Kalium bromida (KBr) Magnesium klorida (MgCl2) Litium klorida (LiCl) Kalium klorida (KCl) Tembaga (II) sulfat (CuSO4)
Larutan elektrolit lemah Dilansir dari Lumen Learning, larutan elektrolit lemah adalah larutan yang zat terlarutnya tidak terurai sempurna menjadi ion-ionnya. Sehingga, zat elektrolit lemah hanya dapat menghantarkan sedikit arus listrik saja.
larutan elektrolit lemah adalah larutan yang zat terlarutnya tidak terurai sempurna menjadi ion-ionnya. Sehingga, zat elektrolit lemah hanya dapat menghantarkan sedikit arus listrik saja
Elektrolit lemah terdiri dari asam lemah, basa lemah, dan beberapa senyawa lainnya (terutama yang menandung nitrogen).
Elektrolit lemah dari asam lemah Berikut adalah contoh larutan elektrolit lemah yang berasal dari asam lemah: Asam fluorida (HF) Asam sulfat (H2SO4) Asam hipoklorit (HClO) Asam format (HCOOH) Asam oksalat (HO2C2O2H) Asam askorbat (H2C6H6O6) Asam fosfat (H3PO4) Asam asetat (CH3COOH) Asam karbonat (H2CO3) Asam borat (H3BO3) Hidrogen peroksida (H2O2) Asam metanoat (HCO2H) Asam benzoat (C6H5COOH) Asam sianida (HCN)
Elektrolit lemah terdiri dari asam lemah, basa lemah, dan beberapa senyawa lainnya (terutama yang menandung nitrogen).
Elektrolit lemah dari asam lemah Berikut adalah contoh larutan elektrolit lemah yang berasal dari asam lemah: Asam fluorida (HF) Asam sulfat (H2SO4) Asam hipoklorit (HClO) Asam format (HCOOH) Asam oksalat (HO2C2O2H) Asam askorbat (H2C6H6O6) Asam fosfat (H3PO4) Asam asetat (CH3COOH) Asam karbonat (H2CO3) Asam borat (H3BO3) Hidrogen peroksida (H2O2) Asam metanoat (HCO2H) Asam benzoat (C6H5COOH) Asam sianida (HCN)
Elektrolit lemah dari basa lemah Berikut adalah contoh larutan elektrolit lemah yang berasal dari basa lemah: Amonia (NH3) Amonium hidroksida (NH4OH) Besi (II) hidroksida (Fe(OH)2) Tembaga (II) hidroksida (Cu(OH)2) Piridin (C5H5N) Etilamin hidroksida (C2H5NH3OH) Metilamin hidroksida (CH3NH3OH)


Komentar
Posting Komentar